ปฏิกิริยาในแบตเตอรี่
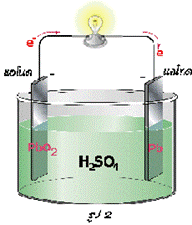
เป็นปฏิกิริยาที่ทำให้เกิดกระแสไฟฟ้า ซึ่งนำมาใช้ประโยชน์ได้หลากหลาย เช่น แบตเตอรี่ที่ใช้ในรถยนต์ประเภทต่างๆ เป็นปฏิกิริยาระหว่างแผ่นตะกั่ว (Pb) ซึ่งทำหน้าที่เป็นขั้วลบ (-) และตะกั่วไดออกไซด์ (PbO2) ทำหน้าที่เป็นขั้วบวก (+) กับกรดซัลฟิวริก (H2SO4) เข้มข้นประมาณ 30-38% โดยน้ำหนักเขียนสมการเคมีของปฏิกิริยาได้ดังนี้
Pb + PbO2 + 2H2SO4 → 2PbSO4 + H2O
แบตเตอรี่อีกชนิดหนึ่ง เรียกว่าแบตเตอรี่ปรอท เป็นแบตเตอรี่ที่มีขนาดเล็กมา เบา จึงนิยมใช้ในเครื่องมือเครื่องใช้อิเล็กทรอนิกส์ เช่น นาฬิกาข้อมือ เครื่องวัดแสงในกล้องถ่ายรูป เครื่องช่วยฟัง เครื่องคิดเลขติดกระเป๋า เป็นต้น ปฏิกิริยาในแบตเตอรี่นี้ มีสังกะสี (Zn) เป็นขั้วลบ (-) และปรอทออกไซด์ (HgO) เป็นขั้วบวก (+) ในสารผสมระหว่างโพแทสเซียมไฮดรอกไซด์ (KOH) กับสังกะสีไฮดรอกไซด์ (ZnO) และน้ำ ซึ่งมีลักษณะคล้ายแป้งเปียก เขียนสมการเคมีของปฏิกิริยาที่เกิดขึ้นได้ดังนี้
Zn + HgO → ZnO + Hg
นอกจากนี้ยังมีแบตเตอรี่ชนิดอื่นๆ อีก เช่น แบตเตอรี่อัลคาไลน์ แบตเตอรี่นิกเกิล-แคดเมียม หรือเรียกสั้นๆ ว่า NICAD และแบตเตอรี่ที่ใส่ในตัวคนไข้ที่หัวใจเต้นไม่ปกติ ซึ่งต่างผลิตกระแสไฟฟ้าจากปฏิกิริยาเคมีของโละและเบสที่แตกต่างกันไป
ปฏิกิริยาในน้ำอัดลม
กรดคาร์บอนิก (H2CO3) ในน้ำอัดลม เมื่อมีการสลายตัวจะให้น้ำและแก๊สคาร์บอนไดออกไซด์ ดังปฏิกิริยา
H2CO3(aq) → H2O(l) + CO2(g)
ปฏิกิริยาในถุงลมนิรภัย [Airbags]
การสลายตัวของโซเดียมเอไซด์ (NaN3) ได้ถูกนำมาใช้ในถุงลมนิรภัยที่ติดตั้งในรถยนต์ เมื่อมีการเผาไหม้ที่เหมาะสมโซเดียมเอไซด์จะสลายตัวให้แก๊สไนโตรเจน(N2) ออกมาในถุงลมนิรภัย ดังปฏิกิริยา
2NaN3(s) → 2Na(s) + 2N2(g)














1 ความคิดเห็น:
ดีครับ
แสดงความคิดเห็น